Nutrition et Cancer
Le cancer est la sixième cause de mortalité dans le monde
Avec 18.1 millions de nouveaux cas et une mortalité estimée à 9,6 millions de morts en 2018 (soit 1 décès sur 6), le cancer est considéré par l’Organisation Mondiale de la Santé (OMS) comme la sixième cause de mortalité dans le monde [1].
-
-
- L’Asie représente à elle seule 1 cas de cancer sur 2 [1]
- L’Europe représente environ 1 cas de cancer sur 5 (23.4%) [1]
- Tout comme les Amériques avec également environ 1 cas sur 5 (21%) des cancers dans le monde [1]
-
Les femmes sont plus touchées par le cancer du sein, colorectal, des poumons et de la thyroïde alors que les hommes sont plus affectés par le cancer des poumons, de la prostate, de l’estomac et du foie [1].
Les patients atteints de cancer sont également dénutris !
Il a été montré dans une étude italienne en 2017 que 9% des patients atteints de cancer étaient dénutris à la première visite et 43% étaient à risque de dénutrition.
Selon la Société Européenne de Nutrition clinique Entérale et Parentérale (ESPEN), la dénutrition est une caractéristique fréquente des patients atteints de cancer, quel que soit l’âge des patients [2]. Il a été montré dans une étude italienne en 2017 que 9% des patients atteints de cancer étaient dénutris à la première visite et 43% étaient à risque de dénutrition [3].
-
-
- D’un côté la dénutrition est la conséquence à la fois de la présence de la tumeur mais aussi des traitements anticancéreux médicaux et chirurgicaux [2]
- D’un autre côté, la dénutrition a également un impact négatif sur la qualité de vie et la tolérance des traitements [2]
-
L’ESPEN estime qu’entre 1 à 2 personnes sur 10 des patients atteints de cancer meurent des suites de la dénutrition plutôt que de la tumeur elle-même [2].
La nutrition a une place toute particulière dans la prise en charge du cancer
Des preuves solides indiquent que les problèmes nutritionnels doivent être pris en compte dès le diagnostic du cancer et doivent être pris en charge en parallèle des traitements. Cependant, la malnutrition liée au cancer est encore largement méconnue, sous-estimée et sous-traitée dans la pratique clinique [2].
Comment le cancer et les traitements peuvent affecter l’alimentation?
Selon le traitement, les personnes atteintes de cancer peuvent avoir différents effets secondaires affectant l’alimentation du patient : [2]
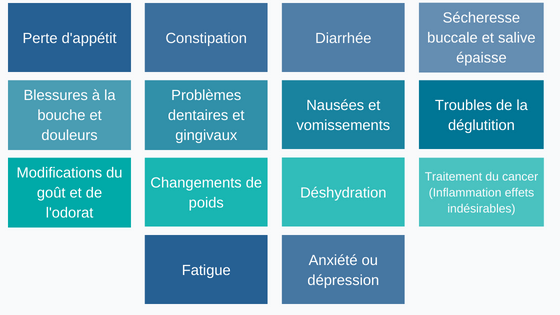
Figure 1 : L’alimentation des patients peut être impactée par de nombreux effets secondaires du cancer
L’alimentation doit avant tout couvrir les besoins énergétiques du patient
Comme dans la population générale, l’alimentation chez le patient atteint de cancer doit absolument répondre à ses besoins énergétiques. Il s’agit de la somme de la dépense énergétique au repos, de l’activité physique et, dans un faible pourcentage, de la thermogenèse induite par l’alimentation.
Bien que la dépense énergétique au repos soit augmentée, la dépense d’énergie totale se voie plutôt diminuée, surtout chez les patients avec un cancer de stade avancé expliquée par une diminution de l’activité physique quotidienne [4,5].
L’ESPEN suppose que la dépense énergétique totale est la même que chez l’individu sain et que le besoin se situe entre 25 et 30kcal/kg de poids corporel/jour [2]. Cela équivaut pour une personne de 70kg à un apport entre 1750 et 2100kcal.
Toutefois, des études montrent qu’il y a environ 50% des patients qui sont hypermétaboliques c’est-à-dire qui ont une dépense énergétique élevée au repos [6,7]. Il est donc important d’apporter plus d’énergie à ces patients ayant un hypermétabolisme Dans ce cas, les besoins énergétiques doivent être adaptés.
Les lipides sont facilement mobilisés par le patient présentant une résistance à l’insuline par rapport aux glucides
En plus de la dénutrition, les patients atteints de cancer peuvent développer des troubles métaboliques telles qu’une résistance à l’insuline. Chez ces patients, l’absorption et l’oxydation du glucose par les cellules musculaires sont altérées; cependant, l’utilisation des graisses est normale voire augmentée, suggérant ainsi un avantage pour un apport alimentaire en lipides plus élevé qu’en glucides pour favoriser un apport énergétique efficace chez ces patients résistant à l’insuline.
Les besoins en protéines sont plus importants chez les patients atteints de cancer
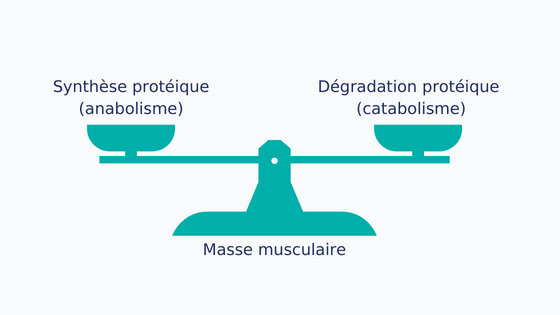
Figure 2 : Equilibre entre anabolisme et catabolisme
Le maintien de la masse musculaire dépend de la balance entre le taux de synthèse des protéines musculaires (anabolisme) et leur dégradation (catabolisme) [8–10]. Chez les patients atteints de cancer, le renouvellement des protéines musculaires peut être perturbé [10,11] cela pour plusieurs raisons :
-
-
- Un apport réduit en protéines en raison de l’anorexie liée à l’inflammation et des effets indésirables du traitement du cancer contribue à la perte musculaire [12,13]
- En plus de l’apport réduit en protéines, la synthèse protéique musculaire est fortement affectée par le niveau d’activité physique [9,14–16], qui est souvent diminuée dans le cas d’un cancer , exacerbant encore le catabolisme, c’est-à-dire la dégradation protéique.
-
Cette perte musculaire chez ces patients s’appelle la cachexie : 50% des patients atteints de cancer sont cachexiques [20] et 60-80% des patients atteints de cancer du poumon, colorectal, tête, estomac et pancréatique [21].
Des études métaboliques ont montré qu’un apport élevé en protéines favorisait la synthèse protéique des protéines musculaires chez les patients atteints de cancer
Des études métaboliques ont montré qu’un apport élevé en protéines favorisait la synthèse protéique des protéines musculaires chez les patients atteints de cancer [22].
C’est pour cette raison que les directives de l’ESPEN recommandent au moins 1g/kg/jour de protéines voire 1.5g/kg/jour quand c’est possible [2]. Par exemple, pour une personne pesant 70kg, cela représente entre 70 et 105g de protéine par jour. En comparaison, il est recommandé pour une adulte sain de consommer 0.8g/kg/jour de protéine.
La qualité des protéines est tout aussi importante que la quantité !
La qualité des protéines se base sur la mesure de sa composition en acides aminés indispensables et sa digestibilité. Plus une protéine est riche en acides aminés indispensables, plus l’organisme sera capable de produire de nouvelles protéines.
En plus de la qualité de la protéine, la vitesse d’absorption des protéines est très importante car en fonction de la vitesse d’absorption des acides aminés dans le sang, les effets sur l’organisme sont différents.
En général, les protéines sériques, telle que le lactosérum, sont qualifiées de protéine dites « rapides » car le passage entre l’estomac et l’intestin est rapide et que, lors de sa digestion, les acides aminés y sont absorbés sur une brève durée [23]. Enfin, il a été montré que l’arrivée rapide des acides aminés dans le sang, notamment de la leucine, induisait une augmentation de la synthèse musculaire [24].
Contrairement aux protéines de lactosérum, l’estomac digère plus lentement les caséines induisant une libération plus lente dans le sang ce qui confère à la caséine une capacité de réduction de la dégradation et d’augmenter la synthèse de protéines musculaires [23,25].
Aujourd’hui, quelques données de la littérature montrent un impact de la qualité de la protéine chez le patient atteint de cancer. Parmi ces études, des résultats indiquent qu’il y a certains avantages à consommer des protéines laitières chez ces patients notamment chez les patients atteints de cachexie. Chez ces patients, des études ont montré que :
-
-
- L’enrichissement d’un mélange de caséine (90%) et de protéine de lactosérum (10%) augmentait la synthèse protéique chez ces patients
- La protéine de lactosérum a permis de préserver les protéines musculaires pendant une période de déficit calorique chronique [26]
- La consommation durant la période périopérative de protéine de lactosérum améliore les capacités physiques fonctionnelles chez des patients ayant subi une résection colorectale [27]
- En plus des conseils nutritionnels, des patients ayant reçu 20g d’isolat de protéine de lactosérum (WPI) (vs groupe conseils nutritionnelle sans WPI) pendant 3 mois ont montré une amélioration du poids corporel, de la force musculaire ou encore une réduction de la toxicité de la chimiothérapie [28]
-
Pour subvenir à ces besoins nutritionnels, des conseils diététiques ou encore de compléments nutritionnels oraux sont recommandés.
Ces conseils incluent : [2]
-
-
- Les conseils diététiques en première intention encourager l’apport en aliment et boissons riches en énergie et en protéines que le patient puisse tolérer,
- Le traitement des symptômes ayant un impact direct sur la prise alimentaire
- Et également proposer les Compléments Nutritionnels Oraux
-
Cette prise en charge nutritionnelle est préférablement initiée quand le patient n’est pas encore sévèrement dénutri [2].
La supplémentation en CNO est conseillée quand l’alimentation enrichie n’est pas efficace pour atteindre les cibles nutritionnelles :
-
-
- Ils sont indiqués quand le patient n’est pas capable de manger moins de 50% des apports en une semaine ou entre 50 et 75% des besoins en 2 jours [2].
-
Conclusion
Pronativ® Protéine Sérique Native et PRONATIV® Caséine Micellaire sont des protéines natives, extraites directement à partir du lait avec un procédé non dénaturant et uniquement physique. Ces produits s’inscrivent tout à fait dans la prise en charge des patients atteints de cancer.
Sources :
[1] Bray, F. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. Cancer J. Clin. 68, 394–424 (2018).
[2] Muscaritoli, M. et al. ESPEN practical guideline: Clinical Nutrition in cancer. Clin. Nutr. Edinb. Scotl. 40, 2898–2913 (2021).
[3] Muscaritoli, M. et al. Prevalence of malnutrition in patients at first medical oncology visit: the PreMiO study. Oncotarget 8, 79884–79896 (2017).
[4] Gibney, E., Elia, M., Jebb, S. A., Murgatroyd, P. & Jennings, G. Total energy expenditure in patients with small-cell lung cancer: results of a validated study using the bicarbonate-urea method. Metabolism. 46, 1412–1417 (1997).
[5] Moses, A. W. G., Slater, C., Preston, T., Barber, M. D. & Fearon, K. C. H. Reduced total energy expenditure and physical activity in cachectic patients with pancreatic cancer can be modulated by an energy and protein dense oral supplement enriched with n-3 fatty acids. Br. J. Cancer 90, 996–1002 (2004).
[6] Bosaeus, I., Daneryd, P., Svanberg, E. & Lundholm, K. Dietary intake and resting energy expenditure in relation to weight loss in unselected cancer patients. Int. J. Cancer 93, 380–383 (2001).
[7] Cao, D. et al. Resting energy expenditure and body composition in patients with newly detected cancer. Clin. Nutr. Edinb. Scotl. 29, 72–77 (2010).
[8] van Vliet, S., Burd, N. A. & van Loon, L. J. The Skeletal Muscle Anabolic Response to Plant- versus Animal-Based Protein Consumption. J. Nutr. 145, 1981–1991 (2015).
[9] Wolfe, R. R. Regulation of Muscle Protein by Amino Acids. J. Nutr. 132, 3219S-3224S (2002).
[10] Phillips, S. M., Glover, E. I. & Rennie, M. J. Alterations of protein turnover underlying disuse atrophy in human skeletal muscle. J. Appl. Physiol. 107, 645–654 (2009).
[11] van der Meij, B. S., Deutz, N. E. P., Rodriguez, R. E. R. & Engelen, M. P. K. J. Increased amino acid turnover and myofibrillar protein breakdown in advanced cancer are associated with muscle weakness and impaired physical function. Clin. Nutr. 38, 2399–2407 (2019).
[12] van der Meij, B. S., Teleni, L., Engelen, M. P. K. J. & Deutz, N. E. P. Amino acid kinetics and the response to nutrition in patients with cancer. Int. J. Radiat. Biol. 95, 480–492 (2019).
[13] Dodson, S. et al. Muscle Wasting in Cancer Cachexia: Clinical Implications, Diagnosis, and Emerging Treatment Strategies. Annu. Rev. Med. 62, 265–79 (2011).
[14] Paddon-Jones, D., Short, K. R., Campbell, W. W., Volpi, E. & Wolfe, R. R. Role of dietary protein in the sarcopenia of aging. Am. J. Clin. Nutr. 87, 1562S-1566S (2008).
[15] Phillips, S. M. Nutrient-rich meat proteins in offsetting age-related muscle loss. Meat Sci. 92, 174–178 (2012).
[16] Deutz, N. E. P. et al. Muscle protein synthesis in cancer patients can be stimulated with a specially formulated medical food. Clin. Nutr. 30, 759–768 (2011).
[17] Hasegawa, Y. et al. Protein intake after the initiation of chemotherapy is an independent prognostic factor for overall survival in patients with unresectable pancreatic cancer: A prospective cohort study. Clin. Nutr. 40, 4792–4798 (2021).
[18] Lawson, C., Ferreira, V., Carli, F. & Chevalier, S. Effects of multimodal prehabilitation on muscle size, myosteatosis, and dietary intake of surgical patients with lung cancer — a randomized feasibility study. Appl. Physiol. Nutr. Metab. 46, 1407–1416 (2021).
[19] Smith, W. A., Nolan, V. G., Robison, L. L., Hudson, M. M. & Ness, K. K. Physical activity among cancer survivors and those with no history of cancer— a report from the National Health and Nutrition Examination Survey 2003-2006. Am. J. Transl. Res. 3, 342–350 (2011).
[20] Tisdale, M. J. Mechanisms of cancer cachexia. Physiol. Rev. 89, 381–410 (2009).
[21] Laviano, A. & Meguid, M. M. Nutritional issues in cancer management. Nutr. Burbank Los Angel. Cty. Calif 12, 358–371 (1996).
[22] Baracos, V. E. Skeletal muscle anabolism in patients with advanced cancer. Lancet Oncol. 16, 13–14 (2015).
[23] Boirie, Y. et al. Slow and fast dietary proteins differently modulate postprandial protein accretion. Proc. Natl. Acad. Sci. U. S. A. 94, 14930–14935 (1997).
[24] Jäger, R. et al. International Society of Sports Nutrition Position Stand: protein and exercise. J. Int. Soc. Sports Nutr. 14, 20 (2017).
[25] Devries, M. C. & Phillips, S. M. Supplemental Protein in Support of Muscle Mass and Health: Advantage Whey. J. Food Sci. 80, A8–A15 (2015).
[26] Coker, R. H., Miller, S., Schutzler, S., Deutz, N. & Wolfe, R. R. Whey protein and essential amino acids promote the reduction of adipose tissue and increased muscle protein synthesis during caloric restriction-induced weight loss in elderly, obese individuals. Nutr. J. 11, 105 (2012).
[27] Gillis, C. et al. Prehabilitation with Whey Protein Supplementation on Perioperative Functional Exercise Capacity in Patients Undergoing Colorectal Resection for Cancer: A Pilot Double-Blinded Randomized Placebo-Controlled Trial. J. Acad. Nutr. Diet. 116, 802–812 (2016).
[28] Cereda, E. et al. Nutritional counseling with or without systematic use of oral nutritional supplements in head and neck cancer patients undergoing radiotherapy. Radiother. Oncol. J. Eur. Soc. Ther. Radiol. Oncol. 126, 81–88 (2018).